Articulo publicado en The British Dental Journal BDJ el 26 de junio de 2020.
Sampson, V., Kamona, N. & Sampson, A. Could there be a link between oral hygiene and the severity of SARS-CoV-2 infections?. Br Dent J 228, 971–975 (2020).
Articulo original → https://doi.org/10.1038/s41415-020-1747-8←
Resumen
El 30 de enero de 2020, la Organización Mundial de la Salud identificó el COVID-19, causado por el virus SARS-CoV-2, como una emergencia global. Los factores de riesgo ya identificados para desarrollar complicaciones de una infección por COVID-19 son la edad, el sexo y las comorbilidades como diabetes, hipertensión, obesidad y enfermedades cardiovasculares. Sin embargo, estos factores de riesgo no explican el otro 52% de las muertes derivadas de COVID-19 en personas a menudo aparentemente sanas. Este artículo investiga el posible vínculo entre el SARS-CoV-2 y la carga bacteriana, cuestionando si las bacterias pueden desempeñar un papel en las superinfecciones bacterianas y complicaciones como la neumonía, el síndrome de dificultad respiratoria aguda y la sepsis. También se examina la conexión entre las complicaciones de COVID-19 y la salud oral y la enfermedad periodontal, ya que las comorbilidades con mayor riesgo de complicaciones de COVID-19 también causan desequilibrios en el microbioma oral y aumentan el riesgo de enfermedad periodontal. Exploramos la conexión entre la alta carga bacteriana en la boca y las complicaciones posvirales, y cómo mejorar la salud oral puede reducir el riesgo de complicaciones por COVID-19.
Puntos clave
- Describe qué es COVID-19 y los factores de riesgo asociados para desarrollar complicaciones.
- Investiga si las bacterias contribuyen a las complicaciones de COVID-19 al causar superinfecciones bacterianas.
- Examina si existe un vínculo entre el microbioma oral y las complicaciones de COVID-19.
Introducción
El 31 de diciembre de 2019, la Organización Mundial de la Salud (OMS) fue informada de un grupo de 27 casos de neumonía sin causa conocida relacionada con un mercado mayorista de animales húmedos en la ciudad de Wuhan, China.1 Para el 7 de enero de 2020, se identificó el virus causante como SARS-CoV-2, que causa la enfermedad COVID-19, y fue declarado emergencia mundial por la OMS el 30 de enero de 2020.
Zhu y col. (2020) pudieron identificar y caracterizar el SARS-CoV-2 utilizando muestras de secuenciación imparcial de pacientes infectados con neumonía.2 El genoma viral reveló que el SARS-CoV-2 era 75-80% idéntico al coronavirus del síndrome respiratorio agudo severo (SARS- CoV) y varios coronavirus de murciélago. Antes de este descubrimiento, se sabía que seis coronavirus causaban enfermedades humanas. Cuatro virus (229E, OC43, NL63 y HKU1) son frecuentes y causan síntomas de resfriado común. Las otras dos cepas son SARS-CoV y el coronavirus del síndrome respiratorio de Medio Oriente (MERS-CoV), que son de origen zoonótico y fatales. El SARS-CoV-2 se ha unido como el séptimo miembro de la familia de los coronavirus que infectan a los seres humanos2. Todavía no se puede acceder a ningún tratamiento específico; Sin embargo, la gestión implica la restricción de los viajes, el aislamiento del paciente y el apoyo de la supervisión médica.
COVID-19 afecta a las personas de diferentes maneras, y los pacientes exhiben una variedad de síntomas y severidad. Si bien los factores de riesgo como la edad, el sexo y las comorbilidades se han destacado por aumentar el riesgo de complicaciones y mortalidad, todavía hay una alta proporción de pacientes sin factores de riesgo identificados que sufren efectos secundarios y complicaciones graves. Tanto como 10-15% de las personas menores de 60 años sin factores de riesgo exhiben reacciones moderadas a severas a COVID-19.1 Si bien COVID-19 tiene un origen viral, se sospecha que en casos severos, las superinfecciones bacterianas pueden contribuir a causar complicaciones como la neumonía y el síndrome de dificultad respiratoria aguda (SDRA). Exploramos la conexión entre la alta carga bacteriana en la boca y las complicaciones posvirales, y cómo mejorar la salud oral puede reducir el riesgo de complicaciones por COVID-19.
Síntomas
Los síntomas clínicos de COVID-19 aparecen después de un período de incubación de aproximadamente 5.2 días4 y varían desde fiebre (98.6%), fatiga (69.6%), tos seca (59.4%), mialgia (34.8%) y dolor de garganta (17.4%) .5 También se ha demostrado que la diarrea es un síntoma distintivo clave de COVID-19 en comparación con el SARS-CoV y el MERS-CoV.6,7
Las infecciones por COVID-19 pueden presentarse con una enfermedad leve, moderada o grave. La gravedad de la enfermedad, la tasa de disminución y el riesgo de mortalidad dependen significativamente de los factores de riesgo destacados por Zhou et al. (2020) en el estudio de cohorte retrospectivo más grande entre pacientes con COVID-19.8 Estos factores de riesgo incluyen la edad (la edad promedio era de 69 años), el sexo (los hombres representaban el 70% de las muertes) y una comorbilidad subyacente en el 48% de los casos (hipertensión 30%, diabetes 19% o enfermedad cardíaca 8%). En abril, una investigación de Europa agregó que la obesidad es un factor de riesgo para desarrollar complicaciones de COVID-19, con un 47,6% de los pacientes en unidades de cuidados intensivos (UCI) con un IMC superior a 30 kg / m2.9 Las principales complicaciones de la enfermedad grave son la sangre coágulos, neumonía, sepsis, shock séptico y SDRA.1 También se ha descubierto que, en algunos casos, una reacción inmune desregulada desencadena la sobreproducción de citocinas proinflamatorias de respuesta temprana (factor de necrosis tumoral [TNF], IL-6 e IL -1β), lo que resulta en una ‘tormenta de citoquinas’.10 Esto expone a los pacientes a un mayor riesgo de hiperpermeabilidad vascular e insuficiencia multiorgánica, particularmente en el corazón y los riñones.11,12,13 Los niveles de IL-6 son comparativamente más altos en no sobrevivientes que aquellos que sobreviven.10
Cuando la neumonía se propaga a los pulmones y los niveles de oxígeno en la sangre caen, los pacientes requieren ventilación asistida, cambiando su diagnóstico de neumonía a SDRA. De 201 pacientes hospitalizados gravemente afectados en China, el 41.8% desarrolló SDRA. De ellos, el 52.4% murió debido a insuficiencia respiratoria, lo que hace que el SDRA sea la causa principal de muerte en pacientes infectados.14 Esto está respaldado por un informe de país que cubre Italia, que muestra que el 96.5% de las complicaciones derivadas de la infección por COVID-19 fueron SDRA, seguidas de insuficiencia renal aguda (29,2%) .15 Esto sugiere que los pacientes tienen más probabilidades de morir por complicaciones de infección post-viral que por COVID-19. El SDRA también fue la mayor causa de muerte por infecciones por SARS-CoV16 y MERS-CoV, 17 confirmando aún más la conexión entre los tres coronavirus. A partir del 3 de marzo de 2020, se pronostica que COVID-19 tendrá una tasa de mortalidad del 3,4% .5 El período desde el inicio de los síntomas hasta la muerte promedia 14 días.
Discusión
Una pregunta significativa sin respuesta es por qué algunos pacientes sufren de COVID-19 más severamente que otros. Aunque los pacientes con factores de riesgo como la edad, el género y las comorbilidades tienen una mayor tasa de complicaciones y mortalidad, todavía hay una alta proporción de pacientes infectados aparentemente jóvenes y sanos sin factores de riesgo identificados que sufren de efectos secundarios y complicaciones graves, mientras que algunos los pacientes infectados nunca desarrollan más que anosmia.18 Es común que las infecciones virales respiratorias predispongan a los pacientes a las sobreinfecciones bacterianas, lo que aumenta la gravedad y la mortalidad de la enfermedad; por ejemplo, durante la pandemia de gripe en 1918, donde la causa principal de muerte no fue por el virus en sí sino por superinfecciones bacterianas. Lo mismo fue evidente en la pandemia de influenza H1N1 2009, donde nuevamente las superinfecciones bacterianas fueron la causa principal de muerte en comparación con el virus en sí mismo.19 A pesar de la importancia comprobada de las superinfecciones en la gravedad de la enfermedad respiratoria, a menudo no se estudian durante los brotes de infección respiratoria. , principalmente debido al hecho de que diagnosticar una superinfección es complejo19.
Se ha demostrado que otros filamentos del coronavirus mejoran la adherencia estreptocócica a las células epiteliales a lo largo del tracto respiratorio, causando complicaciones tales como neumonía20 y daño inflamatorio en los pulmones que inhiben la eliminación de bacterias. Zheng et al.21 compararon los niveles de granulocitos en pacientes que sufren infecciones leves por COVID-19 con aquellos que sufren infecciones graves. Los pacientes que padecían infecciones graves tenían un recuento notablemente más alto de neutrófilos y un recuento de linfocitos significativamente más bajo que en pacientes leves. Un recuento alto de neutrófilos es anormal para una infección viral, pero muy común para una infección bacteriana, lo que resulta en Zheng et al. sospechando que, en casos severos de COVID-19, la superinfección bacteriana es común. Zheng y col. Argumentó que los niveles anormalmente bajos de linfocitos, que generalmente son la línea principal de defensa contra las infecciones virales, indican el agotamiento funcional de las células21 o potencialmente que, en casos graves de la enfermedad, una superinfección bacteriana reemplaza a la infección viral original. Esto está respaldado por el hecho de que Zhou et al. observó que el 50% de los pacientes con COVID-19 grave murieron con la presencia de una infección bacteriana secundaria.
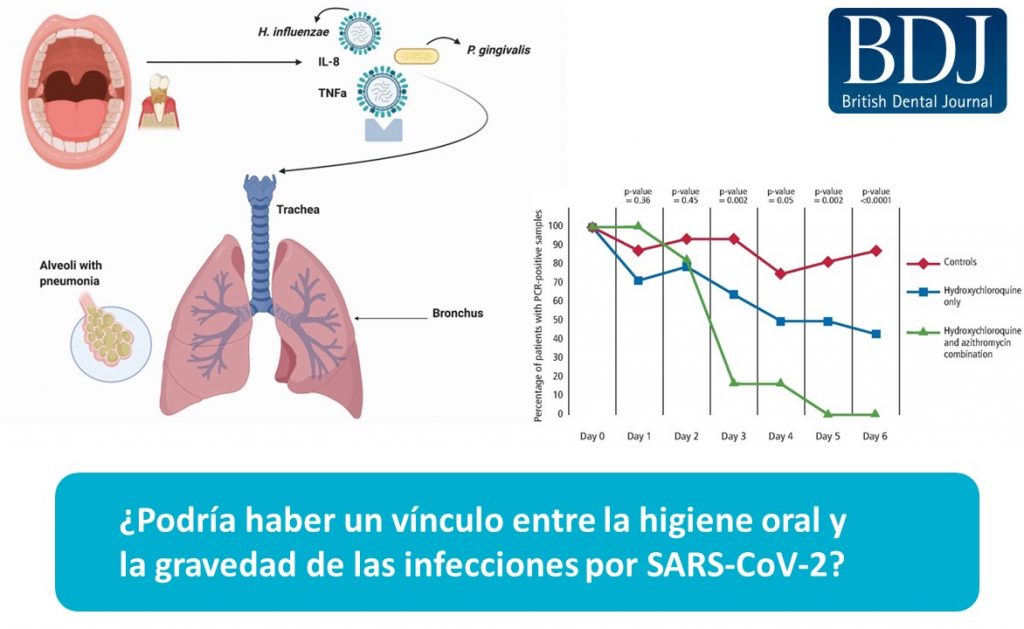
Cuando se reducen los niveles de linfocitos, aumenta la gravedad. Esto también fue visto por Liu et al. 22, quienes dedujeron que la relación de neutrófilos a linfocitos predice la gravedad de la respuesta del paciente a COVID-19. Encontraron que en casos severos, más del 80% de los pacientes tenían una carga bacteriana excepcionalmente alta secundaria a una sobreinfección bacteriana y requerían antibióticos. Esto es respaldado por la prometedora investigación realizada en Francia, 23 donde se demostró que una combinación de hidroxicloroquina (antiviral) y azitromicina (antibiótico) cura al 100% de los pacientes virológicamente después de seis días, en comparación con los pacientes que recibieron hidroxicloroquina sola (57.1%) y aquellos que no recibieron tratamiento (12.5%). Si bien el uso de hidroxicloroquina ha sido muy discutido, es importante entender que los antibióticos claramente juegan un papel influyente en el resultado del tratamiento, mejorando la tasa de éxito en un 42,9% en este caso. Un informe retrospectivo de 1.060 pacientes en mayo de 2020 confirma la eficacia del uso de una combinación de un antibiótico con un antiviral, con un 91,7% curado virológicamente después de diez días.24 Además, Chen et al. informaron que el 71% de los pacientes con COVID-19 en China necesitaban antibióticos al ingresar al hospital, 25 mientras que en Italia, el 84% de los pacientes necesitaban antibióticos, 26 ilustrando la importancia potencial de los antibióticos y, por lo tanto, de las bacterias en el curso de una complicación de COVID-19. 19 Consulte la Figura 1 para ver los resultados de diferentes opciones de tratamiento para COVID-19.
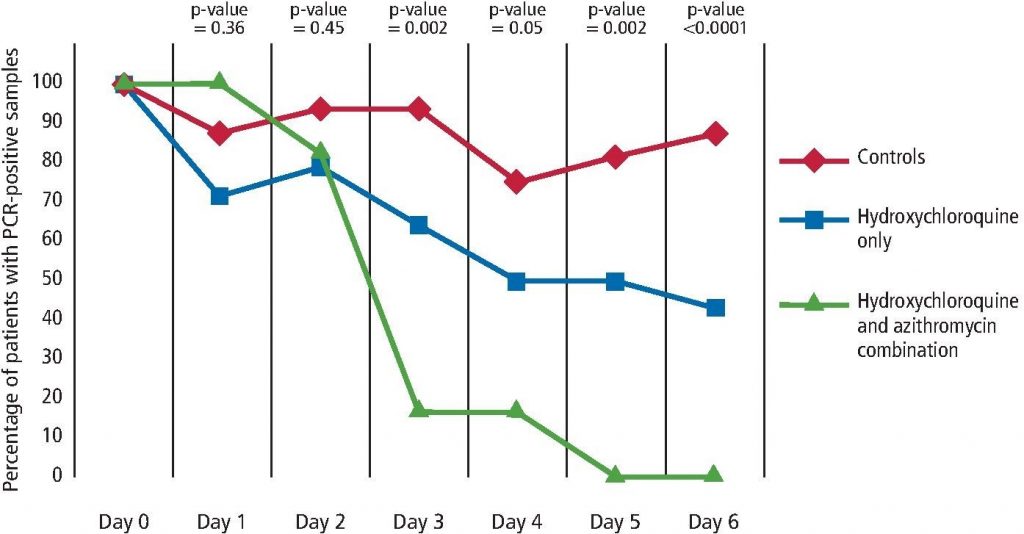
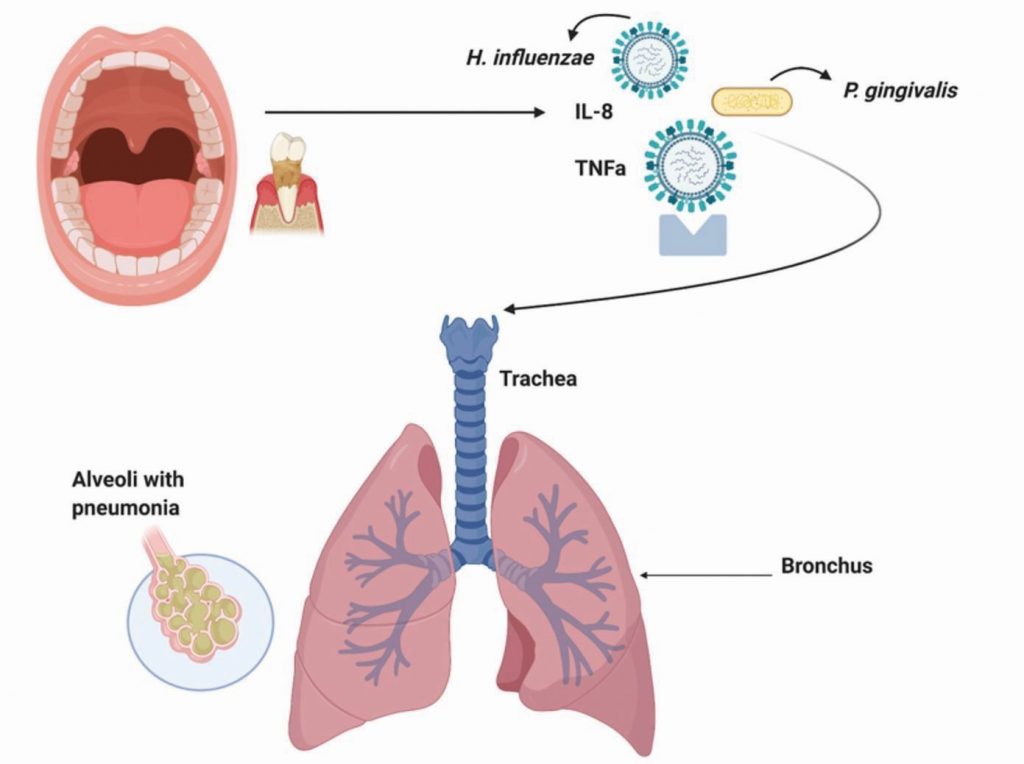
Los pulmones, similares a la cavidad oral, a menudo se conocen como una ‘comunidad ecológica de organismos comensales, simbióticos y patógenos’. 27 La inmigración y eliminación microbiana son constantes entre la cavidad oral y los pulmones, lo que permite una distribución microbiótica saludable.28 Al igual que el intestino o la cavidad oral, las comunidades bacterianas que colonizan los pulmones son reconocidas por su función en la conservación de la homeostasis de tejidos, inmunes y órganos. Sin embargo, los pulmones son únicos, ya que son ricos en oxígeno y, por lo tanto, contienen un equilibrio fino de tensioactivos ricos en lípidos que influyen en la actividad bacteriostática. Este equilibrio puede alterarse drásticamente durante la enfermedad, lo que permite un sobrecrecimiento microbiano y lesiones en los pulmones. La infección de las vías respiratorias inferiores se inicia por la contaminación del epitelio de las vías respiratorias inferiores por inhalación de microorganismos incluidos en gotitas en aerosol o por aspiración de secreciones orales asociadas con enfermedades orales (que contienen microorganismos como P. gingivalis, F. nucleatum, P. intermedia). 29 La periodontitis y la caries son las dos enfermedades orales más comunes asociadas con un desequilibrio de bacterias patológicas en la boca. Las citocinas (como IL-1 y TNF) de tejidos periodontalmente enfermos pueden infiltrarse en la saliva a través del líquido crevicular gingival y aspirar a causar inflamación o infección en los pulmones (Fig. 2) .30 Por lo tanto, una higiene oral inadecuada puede aumentar el riesgo de los intercambios interbacterianos entre los pulmones y la boca, lo que aumenta el riesgo de infecciones respiratorias y posibles complicaciones bacterianas posvirales.31 En un estudio de cohorte basado en la población a nivel nacional, 49.400 pacientes con periodontitis crónica fueron tratados con terapia periodontal durante 11 años. La gráfica de Kaplan-Meier demostró que la incidencia total de neumonía disminuyó significativamente durante un seguimiento de 12 años en el grupo que recibió terapia periodontal (p <0.001). La reducción o erradicación de la enfermedad periodontal reduce significativamente el riesgo de neumonía.
La buena higiene oral ha sido reconocida como un medio para prevenir infecciones de las vías respiratorias en pacientes, especialmente en los mayores de 70 años. La cavidad oral alberga más de 700 bacterias, virus y hongos que pueden colonizar la boca.33 Existen varios hábitats microbiológicos dentro de la boca. ; sin embargo, los habitantes bacterianos principales son P. intermedia, S. mutans, F. nucleatum y P. gingivalis.34
Se han propuesto varios mecanismos para explicar el papel potencial de las bacterias orales en la patogénesis de una infección respiratoria: 30
1)Aspiración de patógenos orales hacia los pulmones.
2)Las enzimas periodontales asociadas a la enfermedad pueden modificar las superficies mucosas para permitir la adhesión y colonización de patógenos respiratorios.
3)Las enzimas periodontales asociadas a la enfermedad pueden destruir las películas salivales de las bacterias para dificultar la eliminación de las superficies mucosas.
4)El epitelio respiratorio puede verse alterado por las citocinas periodontales asociadas para promover la infección por patógenos respiratorios35.
Las bacterias en la biopelícula oral están en una posición privilegiada para ser aspiradas al tracto respiratorio y ayudar a iniciar o progresar afecciones como la neumonía o la sepsis. Una alta carga bacteriana y viral en la boca puede complicar aún más las enfermedades sistémicas como las enfermedades cardiovasculares, el cáncer, las enfermedades neurodegenerativas y las enfermedades autoinmunes, 36 lo que respalda aún más el vínculo entre la boca y el cuerpo. Los factores de riesgo establecidos para COVID-19 (edad, género y comorbilidades) 8 también están fuertemente implicados en los desequilibrios en el microbioma oral. La diabetes, la hipertensión y las enfermedades cardíacas están asociadas con un mayor número de F. nucleatum, P. intermedia y P. gingivalis, 37 y asociadas con la progresión de la enfermedad periodontal. Los pacientes con enfermedad periodontal tienen un riesgo 25% mayor de enfermedad cardiovascular, 38,39 triplican el riesgo de diabetes mellitus40 y un riesgo 20% mayor de hipertensión.41 Sensibilización epitelial y diseminación hematógena de mediadores proinflamatorios como las citocinas, producidas en los enfermos. tejido periodontal, puede aumentar la inflamación sistémica y disminuir el flujo de aire. Esto puede ser exacerbado por la estimulación del hígado para producir proteínas de fase aguda, como la interleucina-6, que potencian la respuesta inflamatoria de los pulmones y el resto del cuerpo.42 De manera similar, los pacientes con infecciones graves por COVID-19 también expresan sistémica inflamación y niveles significativamente más altos de interleucina-6, interleucina-2, interleucina-10, TNF y proteína C reactiva.43
Nagaoka et al.44 investigaron los efectos de las bacterias periodontopáticas como F. nucleatum, P. gingivalis y P. intermedia en la neumonía, y encontraron que P. intermedia en particular indujo neumonía severa en sujetos con niveles más altos de bacterias periodontopáticas. La neumonía y las infecciones respiratorias virales agudas son dos de las infecciones de las vías respiratorias más comunes en pacientes de edad avanzada45 y las mayores causas de muerte en pacientes mayores de 70 años. Un ensayo controlado aleatorio en Japón investigó si la mejora del cuidado bucal redujo la incidencia de neumonía y muertes relacionadas con la neumonía. Cuatrocientos diecisiete pacientes recibieron atención oral después de cada comida y se compararon con el grupo control. Del grupo de control, el 19% contrajo neumonía en comparación con solo el 11% que recibió atención oral. Además, la tasa de mortalidad posterior a la neumonía en el grupo control fue casi el doble que la del grupo del cuidado bucal prescrito.45 En otros estudios, se ha establecido el vínculo entre un buen cuidado bucal y un menor riesgo de infecciones respiratorias virales agudas 30. 46,47,48, incluida una revisión sistemática que concluyó que una de cada diez muertes relacionadas con la neumonía en los ancianos podría prevenirse mejorando la higiene bucal.32 Además, una mejor atención bucal puede reducir significativamente la incidencia de neumonía asociada al ventilador en pacientes de la UCI. 49
Conclusion
The more severe the form of COVID-19, the higher the chance of complications such as pneumonia, ARDS, sepsis, septic shock and death. The development, severity and risk of complications following a COVID-19 infection depend on a number of host and viral factors that will affect a patient’s immune response. While 80% of patients with COVID-19 infections have mild symptoms, 20% progress to have a severe form of infection associated with higher levels of inflammatory markers (IL-2, IL-6, IL-10), bacteria and neutrophil-to-lymphocyte count.
We suggest that the connection between the oral microbiome and COVID-19 complications should be investigated in the process of better understanding the outcomes of COVID-19 disease. The four main comorbidities associated with an increased risk of complications and death from COVID-19 are also associated with altered oral biofilms and periodontal disease, hence why the link between poor oral health and COVID-19 complications is suggested. Periodontopathic bacteria are implicated in systemic inflammation, bacteraemia, pneumonia and even death. Periodontopathic bacteria is also present in the metagenome of patients severely infected with SARS-CoV-2, where high reads for Prevotella (493 reads), Staphylococcus (1,659 reads) and Fusobacterium (463 reads) were discovered.50 It is clear that bacterial superinfections are common in patients suffering from a severe case of COVID-19, with more than 50% of deaths exhibiting bacterial superinfections.19 Furthermore, it is common for respiratory viruses to predispose patients to bacterial superinfections, as seen in the influenza outbreaks in 1918 and 2009.19 Over 80% of patients in ICU exhibited an exceptionally high bacterial load,22 and treatment has been successful with a dual regime of an antiviral and an antibiotic.23
Despite the proven importance of superinfections in the severity of respiratory viral diseases, they are often understudied due to the complexity of diagnosis and culture-based microbiological testing being less sensitive once antibiotics are administered.19
More research should be performed on bacterial superinfections, and the connection, if any, between the oral microbiome and COVID-19 complications are urgently required to establish the importance of oral hygiene and pre-existing oral disease in the severity and mortality risk of COVID-19.
Meanwhile, we recommend that oral hygiene be maintained, if not improved, during a SARS-CoV-2 infection in order to reduce the bacterial load in the mouth and the potential risk of a bacterial superinfection. We recommend that poor oral hygiene be considered a risk to post-viral complications, particularly in patients already predisposed to altered biofilms due to diabetes, hypertension or cardiovascular disease. Bacteria present in patients with severe COVID-19 are associated with the oral cavity and improved oral hygiene may play a part in reducing the risk of complications.
References
1.
World Health Organisation. Clinical Management of severe acute respiratory infection when novel coronavirus (2019-nCoV) infection is suspected. 2020. Available online at https://apps.who.int/iris/handle/10665/330893 (accessed June 2020).
2.
Zhu N, Zhang D, Wang W. A novel coronavirus from patients with pneumonia in China. N Engl J Med 2020; 382: 727-733.
3.
Zhang H, Penninger J M, Li Y, Zhong N, Slutsky A S. Angiotensin-converting enzyme 2 (ACE2) as a SARSCoV2 receptor: molecular mechanisms and potential therapeutic target. Intensive Care Med 2020; 46: 586-590.
4.
Li Q, Guan X, Wu P et al. Early transmission dynamics in wuhan, China, of novel coronavirus infected pneumonia. N Engl J Med 2020; 382: 1199-1207.
5.
World Health Organisation. Coronavirus disease (COVID-19) pandemic. 2020. Available online at https://www.who.int/emergencies/diseases/novel-coronavirus-2019 (accessed June 2020).
6.
Rothan H A, Byrareddy S N. The epidemiology and pathogenesis of coronavirus disease (COVID-19) outbreak. J Autoimmun 2020; DOI: 10.1016/j.jaut.2020.102433.
7.
Greenland J R, Michelow M D, Wang L, London M J. COVID-19 Infection: Implications for Perioperative and Critical Care Physicians. Anesthesiology 2020; 132: 1346-1361.
8.
Zhou F, Yu T, Du R et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospectove study. Lancet 2020; 395: 1054-1062.
9.
Simonnet A, Chetboun M, Poissy J et al. High prevalence of obesity in severe acute respiratory syndrome coronavirus-2 (SARSCoV2) requiring invasive mechanical ventilation. Obesity (Silver Spring) 2020; DOI: 10.1002/oby.22831.
10.
Tay M Z, Poh C M, Rénia L, MacAry P A, Ng L F P. The Trinity of COVID-19: Immunity, Inflammation and Intervention. Nat Rev Immunol 2020; 20: 363-374.
11.
Jose R J, Manuel A. COVID-19 cytokine storm: the interplay between inflammation and coagulation. Lancet Respir Med 2020; DOI: 10.1016/S2213-2600(20)30216-2.
12.
Perico L, Benigni A, Remuzzi G. Should COVID-19 Concern Nephrologists? Why and to What Extent? The Emerging Impasse of Angiotensin Blockade. Nephron 2020; 144: 213-221.
13.
Yao X H, Li T Y, He Z C et al. A pathological report of three COVID-19 cases by minimally invasive autopsies. Chin J Pathol 2020; 49: 411-417.
14.
Wu C, Chen X, Cai Y et al. Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern Med 2020; DOI: 10.1001/jamainternmed.2020.0994.
15.
European Centre for Disease Prevention and Control. Coronavirus disease 2019 (COVID-19) pandemic: increased transmission in the EU/EEA and the UK – seventh update. 2020. Available at https://www.ecdc.europa.eu/sites/default/files/documents/RRA-seventh-update-Outbreak-of-coronavirus-disease-COVID-19.pdf (accessed June 2020).
16.
Rubenfeld G D. Is SARS just ARDS? JAMA 2003; 290: 397-399.
17.
Li X, Geng M, Peng Y, Meng L, Lu S. Molecular immune pathogenesis and diagnosis of COVID-19. J Pharm Anal 2020; 10: 102-108.
18.
Shi Y, Wang Y, Shao C et al. COVID-19 infection: the perspectives on immune responses. Cell Death Differ 2020; 27: 1451-1454.
19.
Cox M J, Loman N, Bogaert D, O’Grady J. Co-infections: potentially lethal and unexplored in COVID-19. Lancet 2020; DOI: 10.1016/S2666-5247(20)30009-4.
20.
Golda A, Malek N, Dudek B et al. Infection with human coronavirus NL63 enhances streptococcal adherence to epithelial cells. J Gen Virol 2011; 92: 1358-1368.
21.
Zheng M, Gao Y, Wang G et al. Functional exhaustion of antiviral lymphocytes in COVID-19 patients. Cell Mol Immunol 2020; 17: 533-535.
22.
Liu J, Liu Y, Xiang P et al. Neutrophil to Lymphocyte Ratio Predicts Critical Illness Patients with 2019 Coronavirus Disease in the Early Stage. J Transl Med 2020; 18: 206.
23.
Gautret P, Lagier J-C, Parola P et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial. Int J Antimicrob Agents 2020; DOI: 10.1016/j.ijantimicag.2020.105949.
24.
Million M, Lagier J-C, Gautret P et al. Early Treatment of COVID-19 Patients With Hydroxychloroquine and Azithromycin: A Retrospective Analysis of 1061 Cases in Marseille, France. Travel Med Infect Dis 2020; DOI: 10.1016/j.tmaid.2020.101738.
25.
Chen T, Wu D, Chen H et al. Clinical characteristics of 113 deceased patients with coronavirus disease 2019: retrospective study. BMJ 2020; DOI: 10.1136/bmj.m1091.
26.
Sorbello M, El-Boghdadly K, Di Giacinto I et al. The Italian Coronavirus Disease 2019 Outbreak: Recommendations From Clinical Practice. Anaesthesia 2020; 75: 724-732.
27.
Toraldo D M, Conte L. Influence of the Lung Microbiota Dysbiosis in Chronic Obstructive Pulmonary Disease Exacerbations: The Controversial Use of Corticosteroid and Antibiotic Treatments and the Role of Eosinophils as a Disease Marker. J Clin Med Res 2019; 11: 667-675.
28.
Mathieu E, Escribano-Vazquez U, Descamps D et al. Paradigms of Lung Microbiota Functions in Health and Disease, Particularly, in Asthma. Front Physiol 2018; DOI: 10.3389/fphys.2018.01168.
29.
Scannapieco F A, Genco R J. Association of periodontal infections with atherosclerotic and pulmonary diseases. J Periodontal Res 1999; 34: 340-345.
30.
Scannapieco F A. Role of Oral Bacteria in Respiratory Infection. J Periodontol 1999; 70: 793-802.
31.
Paju S, Scannapieco F A. Oral biofilms, periodontitis, and pulmonary infections. Oral Dis 2007; 13: 508-512.
32.
Sjögren P, Nilsson E, Forsell M, Johansson O, Hoogstraate J. A systematic review of the preventative effect of oral hygiene on pneumonia and respiratory tract infection in elderly people in hospitals and nursing homes: effect estimates and methodological quality of randomised controlled trials. J Am Geriatr Soc 2008; 56: 2124-2130.
33.
Aas J A, Paster B J, Stokes L N, Olsen I, Dewhirst F E. Defining the normal bacterial flora of the oral cavity. J Clin Microbiol 2005; 43: 5721-5732.
34.
Huffnagle G B, Dickson R P, Lukacs N W. The respiratory tract microbiome and lung inflammation: a two-way street. Mucosal Immunol 2017; 10: 299-306.
35.
Hayata M, Watanabe N, Tamura M. The Periodontopathic Bacterium Fusobacterium nucleatum Induced Proinflammatory Cytokine Production by Human Respiratory Epithelial Cell Lines and in the Lower Respiratory Organs in Mice. Cell Physiol Biochem 2019; 53: 49-61.
36.
Olsen I, Yamazaki K. Can oral bacteria affect the microbiome of the gut? J Oral Microbiol 2019; DOI: 10.1080/20002297.2019.1586422.
37.
Takahashi K, Nishimura F, Kurihara M et al. Subgingival microflora and antibody responses against periodontal bacteria of young Japanese patients with type 1 diabetes mellitus. J Int Acad Periodontol 2001; 3: 104-111.
38.
DeStefano F, Anda R F, Kahn H S, Williamson D F, Russell C M. Dental disease and the risk of coronary heart disease and mortality. BMJ 1993; 306: 688-691.
39.
Paizan M L M, Vilela-Martin J F. Is There an Association between Periodontitis and Hypertension? Curr Cardiol Rev 2014; 10: 355-361.
40.
Preshaw P M, Alba A L, Herrera D et al. Periodontitis and diabetes: a two-way relationship. Diabetologia 2012; 55: 21-31.
41.
Aguilera E M, Suvan J, Buti J et al. Periodontitis is associated with hypertension: a systematic review and meta-analysis. Cardiovasc Res 2020; 116: 28-39.
42.
Gomes-Filho I S, Seixas da Cruz S, Trindade S C et al. Periodontitis and respiratory diseases: a systematic review with meta-analysis. Oral Dis 2020; 26: 439-446.
43.
Gong J, Dong H, Xia S Q et al. Correlation Analysis Between Disease Severity and Inflammation-related Parameters in Patients with COVID-19 Pneumonia. 2020. Available online at https://www.medrxiv.org/content/10.1101/2020.02.25.20025643v1 (accessed June 2020).
44.
Nagaoka K, Yanagihara K, Morinaga Y et al. Prevotella intermedia Induces Severe Bacteraemic Pneumococcal Pneumonia in Mice with Upregulated Platelet-Activating Factor Receptor Expression. Infect Immun 2014; 82: 587-593.
45.
Yoneyama T, Yoshida M, Ohrui T et al. Oral care reduces pneumonia in older patietns in nursing homes. J Am Geriatr Soc 2002; 50: 430-433.
46.
Abe S, Ishihara K, Adachi M, Sasaki H, Tanaka K, Okuda K. Professional oral care reduced influenza infection in elderly. Arch Gerontol Geriatr 2006; 43: 157-164.
47.
Quagliarello V, Ginter S, Han L, Van Ness P, Allore H, Tinetti M. Modifiable risk factors for nursing home-acquired pneumonia. Clin Infect Dis 2005; 40: 1-6.
48.
Imsand M, Janssens J P, Auckenthaler R, Mojon P, Budtz-Jørgensen E. Bronchopneumonia and oral health in hospitalised older patients. Gerodontology 2002; 19: 66-72.
49.
Mori H, Hirasawa H, Oda S, Shiga H, Matsuda K, Nakamura M. Oral Care reduced incidence of ventilator associate pneumonia in ICU populations. Intensive Care Med 2006; 32: 230-236.
50.
Chakraborty S. Metagenome of SARS-Cov2 patients in Shenzhen with travel to Wuhan shows a wide range of species – Lautropia, Cutibacterium, Haemophilus being most abundant – and Campylobacter explaining diarrhoea. 2020. Available online at https://osf.io/jegwq (accessed June 2020).
Información del autor
Afiliaciones
Odontología, 38 Devonshire Street, Londres, W1G 6QB, Reino Unido
Victoria Sampson
Centre for Nutrition Education & Lifestyle Management, Londres, RG40 1DH, Reino Unido
Nawar Kamona
Ortodoncia, Cambridge University Hospital Trust, Cambridge, CB1 00Q, Reino Unido
Ariane Sampson
Autor correspondiente
Correspondencia a Victoria Sampson.
Declaraciones de ética
Los autores declaran no tener conflictos de interés relacionados con el estudio.
Derechos y permisos
Permisos para divulgar.